nombre : juan fernando galvis perea
grado 11-3 T
A aquellos compuestos químicos orgánicos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno enlazado de forma covalente a un átomo de carbono. Además, este carbono debe estar saturado, es decir, debe tener solo enlaces simples a sendos átomos esto diferencia a los alcoholes de los fenoles
propiedades quimica
La reacción de un alcohol primario con ácido crómico (CrO3) en presencia de piridina produce un aldehído:
la reacción de un alcohol primario en presencia del reactivo de jones produce un ácido carboxilo:

la reacción de un alcohol secundario en presencia de permanganato de potasio produce una cetona:

DESHIDROGENACION : Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.
DESHIDRATACION : es una propiedad de los alcoholes mediante la cual podemos obtener eteres o alquenos:
R-R-OH ------------) R=R + H2O
REACCION CON CLORURO DE TIONILO:
El cloruro de tionilo (SOCl2) se puede usar para convertir alcoholes en el correspondiente cloruro de alquilo en una reacción simple que produce HCl gaseoso y SO2.

SOLUBILIDAD EN EL AGUA : .Gracias al grupo -OHcaracterístico de los alcoholes, se pueden presentar puentes dehidrógeno, que hace que los primeros alcoholes sean solubles en el agua, mientras que a mayor cantidad de hidrógeno, dicha característica va desapareciendo debido a que el grupo hidroxilo va perdiendosignificancia y a partir del hexanol la sustancia se torna aceitosa.
El cloruro de tionilo (SOCl2) se puede usar para convertir alcoholes en el correspondiente cloruro de alquilo en una reacción simple que produce HCl gaseoso y SO2.
PROPIEDADES FISICA
SOLUBILIDAD EN EL AGUA : .Gracias al grupo -OHcaracterístico de los alcoholes, se pueden presentar puentes dehidrógeno, que hace que los primeros alcoholes sean solubles en el agua, mientras que a mayor cantidad de hidrógeno, dicha característica va desapareciendo debido a que el grupo hidroxilo va perdiendosignificancia y a partir del hexanol la sustancia se torna aceitosa.
PUNTO DE EBULLICION: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones. Todo esto se presenta porque el grupo OH al tener puentes de hidrogeno, son mas dificiles de romper.
PUNTO DE FUSION: Presenta el mismo comportamiento que el punto de ebullicion, aumenta a medida que aumenta el numero de carbonos.
DENSIDAD: Aumenta conforme aumenta el numero de carbonos y las ramificaciones de las moleculas.
etanol:El compuesto químico etanol, conocido como alcohol etílico, es un alcohol que se presenta en condiciones normales de presión y temperatura como un líquido incoloro e inflamable con un punto de ebullición de 78,4 °C.
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Su fórmula química es CH3-CH2-OH (C2H6O)
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Su fórmula química es CH3-CH2-OH (C2H6O)
Estado de agregación : Líquido
Apariencia : Incoloro
Densidad : 789 kg/m3; 0,789g/cm3
Masa molar : 46,07 g/mol
Punto de fusión : 158,9 K (-114 °C)
Punto de ebullición : 351,6 K (78 °C)
Temperatura crítica : 514 K (241 °C)
Presión crítica : 63 atm
Viscosidad : 1.074 mPa·s a 20 °C.
Propiedades químicas
Acidez :15,9 pKa
Solubilidad en agua : Miscible
combustible:
Se emplea como combustible industrial y doméstico. En el uso doméstico se emplea el alcohol de quemar. Este además contiene compuestos como la pirovidos exclusivamente a alcohol. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto. Estudios del Departamento de Energía de EUA dicen que el uso en automóviles reduce la producción de gases de invernadero en un 85%. En países como México existe la política del ejecutivo federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60%.
estanol:El compuesto químico metanol, también conocido como alcohol metílico o alcohol de madera, es el alcohol más sencillo. A temperatura ambiente se presenta como un líquido ligero (de baja densidad), incoloro, inflamable y tóxico que se emplea como anticongelante, disolvente y combustible. Su fórmula química es CH3OH (CH4O).
 Estado de agregación Líquido
Estado de agregación Líquido
Apariencia Incoloro
Densidad 791,8 kg/m3; 0.7918g/cm3
Masa molar 32,04 g/mol
Punto de fusión 176 K (-97 °C)
Punto de ebullición 337,8 K (65 °C)
Presión crítica 81±1 atm
Viscosidad 0,59 mPa·s a 20 °C.
Propiedades químicas
Acidez ~ 15,5 pKa
Solubilidad en agua totalmente miscible.
Producto de solubilidad n/d
Momento dipolar 1,69 D
propanal:El propanal, aldehído propiónico o Propaldehído, es compuesto formado por un radical alquilo (propil o propilo), que lleva consigo un grupo carbonilo, pero lo que lo diferencia de las cetonas es que este es exclusivamente terminal.
El propanal consta de tres carbonos y un grupo aldehído (CHO). El carbono del aldehído está unido a el oxígeno por un doble enlace. Está también unido a un hidrógeno. Esta función orgánica, no puede formar puentes de hidrógeno, debido a que su oxígeno no está directamente enlazado con ninguno de los dos otros elementos necesarios para formar puentes; flúor e hidrógeno. Es por esto que su punto de ebullición no es tan alto como los compuestos que sí forman puentes de hidrógeno.
 Estado de agregación : Líquido
Estado de agregación : Líquido
Apariencia : Incoloro
Densidad : 789 kg/m3; 0,789g/cm3
Masa molar : 46,07 g/mol
Punto de fusión : 158,9 K (-114 °C)
Punto de ebullición : 351,6 K (78 °C)
Temperatura crítica : 514 K (241 °C)
Presión crítica : 63 atm
Viscosidad : 1.074 mPa·s a 20 °C.
Propiedades químicas
Acidez :15,9 pKa
Solubilidad en agua : Miscible
combustible:
Se emplea como combustible industrial y doméstico. En el uso doméstico se emplea el alcohol de quemar. Este además contiene compuestos como la pirovidos exclusivamente a alcohol. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto. Estudios del Departamento de Energía de EUA dicen que el uso en automóviles reduce la producción de gases de invernadero en un 85%. En países como México existe la política del ejecutivo federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60%.
Alcoholes amílicos: El alcohol amílico es un compuesto orgánico incoloro con la fórmula C5H11OH, este compuesto es conocido por tener ocho estructuras moleculares diferentes. Posee una densidad de 0,8247 g/cm3 (a 0 °C) y tiene un punto de ebullición de 131,6 °C, es poco soluble en agua, pero es más soluble en solventes orgánicos. Posee un característico olor fuerte y un sabor muy ardiente al paladar. En su forma pura, no es tóxico, aunque los productos impuros sí lo son. En su transformación a vapor, se descompone con la producción de acetileno, etileno, propileno y otros compuestos. Es oxidado por el ácido crómico y se convierte en isovaleraldehído, y en su forma cristalina se añaden compuestos como el cloruro de calcio y el cloruro de estaño(IV).
isomeros : este alcohol posee ocho
 Estado de agregación Líquido
Estado de agregación LíquidoApariencia Incoloro
Densidad 791,8 kg/m3; 0.7918g/cm3
Masa molar 32,04 g/mol
Punto de fusión 176 K (-97 °C)
Punto de ebullición 337,8 K (65 °C)
Presión crítica 81±1 atm
Viscosidad 0,59 mPa·s a 20 °C.
Propiedades químicas
Acidez ~ 15,5 pKa
Solubilidad en agua totalmente miscible.
Producto de solubilidad n/d
Momento dipolar 1,69 D
propanal:El propanal, aldehído propiónico o Propaldehído, es compuesto formado por un radical alquilo (propil o propilo), que lleva consigo un grupo carbonilo, pero lo que lo diferencia de las cetonas es que este es exclusivamente terminal.
El propanal consta de tres carbonos y un grupo aldehído (CHO). El carbono del aldehído está unido a el oxígeno por un doble enlace. Está también unido a un hidrógeno. Esta función orgánica, no puede formar puentes de hidrógeno, debido a que su oxígeno no está directamente enlazado con ninguno de los dos otros elementos necesarios para formar puentes; flúor e hidrógeno. Es por esto que su punto de ebullición no es tan alto como los compuestos que sí forman puentes de hidrógeno.
 Estado de agregación : Líquido
Estado de agregación : Líquido
Apariencia : Incoloro, de olor acre.
Densidad : 800 kg/m3; 0,8g/cm3
Masa molar : 58,1 g/mol
Punto de fusión: 192 K (-81 °C)
Punto de ebullición :322 K (49 °C)
Viscosidad :0.6
Propiedades químicas
Solubilidad en aguaSoluble
Momento dipolar :2.52 D
Familia Aldehídos
USO DEL ALCOHOL
EL METANOL: Es muy toxico, su ingestión puede causar ceguera y hasta la muerte. Es un combustible de alto rendimiento por lo que se lo usa como combustible de autos de carreras.Pero como combustible es menos conocido que el etanol debido a sus altos costos.
EL PROPANOL: Se utiliza como un antiséptico aún más eficaz que el alcohol etílico; su uso mas común es en forma de quita esmalte oremovedor .Disolvente para lacas, resinas, revestimientos y ceras. También para la fabricación de líquido de frenos, ácidopropiónico y plastificadores.
BENEFICIOS Y RIESGOS PARA LA SALUD
debemos recordar que el alcohol y su consumo causa grandes problemas a la salud, sobre todo cerebrales.
BIBLIOGRAFÍA
| Éster
(éster de ácido carboxílico)
| Éster carbónico
(éster de ácido carbónico)
| Éster fosfórico
(triéster de ácido fosfórico)
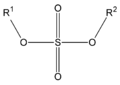
| Éster sulfúrico
(diéster de ácido sulfúrico)
|
|---|---|---|---|
 |  |  |  |
propiedades quimica
Hidrólisis ácida:Ante el calor, se descomponen regenerando el alcohol y el ácido correspondiente. Se usa un exceso de agua para inclinar esta vez la reacción hacia la derecha. Como se menciono es la inversa de la esterificación.

Hidrólisis en medio alcalino:En este caso se usan hidróxidos fuertes para atacar al éster, y de esta manera regenerar el alcohol. Y se forma la sal del ácido orgánico.

Propiedades físicas
usos de esteres
Disolventes :Los ésteres de bajo peso molecular son líquidos y se acostumbran a utilizar como disolventes, especialmente los acetatos de los alcoholes metílico, etílico y butílico.
Plastificantes :El acetatopropionato de celulosa y el acetatobutirato de celulosa han conseguido gran importancia como materiales termoplásticos. El nitrato de celulosa con un contenido de 10,5-11% de nitrógeno se llama piroxilina y con alcohol y alcanfor (plastificante) forma el celuloide. El algodón dinamita es nitrato de celulosa con el 12,5-13,5% de nitrógeno. La cordita y la balistita se fabrican a partir de éste, que se plastifica con trinitrato de glicerina (nitroglicerina). Los sulfatos de dimetilo y dietilo (ésteres del ácido sulfúrico) son excelentes agentes de alcoholización de moléculas orgánicas que contienen átomos de hidrógeno lébiles, como por ejemplo, el midón y la celulosa.
Aromas artificiales :Muchos de los ésteres de bajo peso molecular tienen olores característicos a fruta: plátano (acetado de isoamilo), ron (propionato de isobutilo) y piña (butirato de butilo). Estos ésteres se utilizan en la fabricación de aromas y perfumes sintéticos.
Aditivos Alimentarios : Estos mismos ésteres de bajo peso molecular que tienen olores característicos a fruta se utilizan como aditivos alimentarios, por ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.
Productos Farmacéuticos : Productos de uso tan frecuente como los analgésicos se fabrican con ésteres.
Polímeros Diversos :Los ésteres de los ácidos no saturados, por ejemplo, del ácido acrílico o metacrílico, son inestables y se polimerizan rápidamente, produciendo resina; así, el metacrilato de metilo (lucita o plexiglás). De manera análoga los ésteres de los alcoholes no saturados son inestables y reaccionan fácilmente con ellos mismos; así, el acetado de vinilo se polimeriza dando acetato de polivinilo. Las resinas de poliéster, conocidas como gliptales, resultan de la poliesterificación de la glicerina con anhídrido ftálico; el proceso puede controlarse de manera que se produzca una resina fusible o infusible. Cuando la poliesterificación se realiza en presencia de un ácido no saturado de cadena larga del tipo de los aceites secantes, la polimerización de éste por oxidación se superpone a la poliesterificación y se producen los esmaltes sintéticos, duros y resistentes a la intemperie, que son muy adecuados por el acabado de los automóviles. La poliesterificación del etilenglicol con el ácido tereftálico produce fibra de poliéster. Si se da forma de láminas a este material, constituye una excelente película fotográfica.
Repelentes de insectos :Todos los repelentes de insectos que podemos encontrar en el mercado contienen ésteres.
Fórmula: H2CO3
Densidad: 1.000,00 kg/m³
Denominación de la IUPAC: Carbonic acid
Soluble en: Agua
Éster de ácido carboxílico: Los ácidos carboxílicos constituyen un grupo de compuestos, caracterizados porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.
BENEFICIOS Y RIESGOS PARA LA SALUD
Los estudios han mostrado daños en el hígado, riñones, pulmones y testículos. Por otra parte, un estudio japonés publicado en 2006 realizado con primates jóvenes no ha encontrado daños testiculares de ningún tipo. El Instituto de Sanidad y Protección al Consumidor de la Oficina Química Europea ha encontrado que dos de los ftalatos considerados peligrosos para el hombre y prohibidos en la UE (el DINF o diisononilftalato y el DIDP o diisodecilftalato) no suponen un riesgo para la salud humana o para el medio ambiente en su formas de uso actuales.
También causa confusión en animales como roedores.
El MINISTERIO DE SALUD ha tomado conocimiento de la posible existencia de riesgos para la salud de los niños menores de (TRES) 3 años por el empleo de ésteres de ácido ftálico como plastificantes en la fabricación de mordillos y otros artículos de puericultura, así como de juguetes que puedan ser mordidos o chupados.
Que si bien se reconoce que existen diversas fuentes de exposición a los ésteres de ácido ftálico tales como el aire, el ambiente, el agua de bebida y los alimentos, ante la posibilidad de que tengan efectos adversos sobre la salud el COMITE CIENTIFICO SOBRE TOXICIDAD, ECOTOXICIDAD Y MEDIO AMBIENTE de la UNION EUROPEA ha recomendado la adopción de medidas precautorias de restricción en el uso de ésteres de ácido ftálico en mordillos y juguetes pasibles de ser mordidos, destinados a niños menores de (TRES) 3 años.
BIBLIOGRAFÍA
éteres
propiedades quimica
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas.
En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación.
Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
(Apertura catalizada por ácido) El nucleófilo ataca al carbono más sustituido.
( Apertura por neoclófilo) El neoclófilo ataca al carbono menos sustituido.
propiedades fisica
Uso éteres
anestésico:Los anestésicos locales (AL), son fármacos universalmente utilizados por multitud de profesionales de la salud (anestesiólogos, cirujanos, odontólogos, podólogos, dermatólogos, internistas,médicos veterinarios, etc.)
COMPUESTOS MÁS REPRESENTATIVOS
Éter etílico :El éter etílico, o dietiléter es un éter líquido, incoloro, muy inflamable, con un bajo punto de ebullición, de sabor acre y ardiente. Es más ligero que el agua, sin embargo su vapor es más denso que el aire.

Fórmula: (C2H5)2O
Densidad: 713,40 kg/m³
Punto de ebullición: 34,6 °C
Masa molar: 74,12 g/mol
Denominación de la IUPAC: Ethoxyethane
BIBLIOGRAFÍA
http://kira2629.wordpress.com/2009/06/20/propiedades-fisicas-y-quimicas-de-los-eteres/
http://www.quimicaorganica.org/eteres/466-propiedades-fisicas-de-los-eteres.html
http://es.wikipedia.org/wiki/Anest%C3%A9sico_local
http://html.rincondelvago.com/eteres-y-epoxidos.html
http://espanol.answers.yahoo.com/question/index?qid=20090112121620AAzCrsZ
http://es.wikipedia.org/wiki/%C3%89ter_et%C3%ADlico
http://www.ehowenespanol.com/eter-isopropilico-hechos_46721/





.jpg)
.jpg)
.jpg)











.jpg)
.jpg)




.jpg)

.jpg)
.jpg)





.png)
.png)
.jpg)

.jpg)
https://tightwriters.com/como-graficar-coordenadas-polares-con-valores-negativos/ Éter etílico :El éter etílico, o dietiléter es un éter líquido, incoloro, muy inflamable, con un bajo punto de ebullición, de sabor acre y ardiente. Es más ligero que el agua, sin embargo su vapor es más denso que el aire.
ResponderEliminar